Aparato para interferir en los procesos de supervivencia de células patológicas.
Campo de la invención
La presente invención se refiere generalmente a un aparato para interferir en los procesos de supervivencia de
células patológicas, en particular, células afectadas por cáncer y otras enfermedades producidas por alteraciones en el
mecanismo de la supervivencia celular.
En particular la interferencia se induce por medio de campos electromagnéticos de frecuencia extremadamente
baja (ELF) y estáticos (S) producidos por el aparato.
Los campos magnéticos estáticos y electromagnéticos de frecuencia extremadamente baja se denominan más adelante
en el presente documento también como S y ELF, respectivamente. Además, cualquier posible combinación de
diferentes secuencias de campos S y/o ELF, tales como campos S seguidos por campos ELF, campos ELF seguidos
por campos S, campo S y ELF juntos así como la presencia de campos S o ELF solos, se denominarán más adelante
en el presente documento también como campos SELF.
Antecedentes de la invención
Se sabe que los campos y las corrientes pericelulares inducidos por un campo electromagnético de frecuencia
extremadamente baja (ELF), cuyo intervalo de frecuencia es de desde 1 Hz hasta 300 Hz y quizá de hasta 1000 Hz,
inducen en la célula ciertos acontecimientos electroquímicos de membrana que son importantes para procesos de
amplificación y transducción primaria de señales biológicas.
Estos acontecimientos mediados bioquímicamente producen entonces segundos mensajeros citoplasmáticos y efectores
internos tales como Ca++ libre y fosforilasas proteicas (cinasas) que, a su vez, desencadenan ciertos cambios en
la biosíntesis de macromoléculas además de producir alteraciones en la diferenciación del crecimiento celular y propiedades
funcionales [1M. Blank, 1993].
Además, se ha documentado la posibilidad de que los campos S y ELF afecten a la síntesis de ADN, la transcripción,
la traducción y la integridad del ADN [2Liboff 1984, 3Tofani 1995, 4Goodman 1991, 5Phillips 1992].
Un posible mecanismo físico que explica algunos de los hallazgos experimentales es el efecto directo sobre los
iones (es decir, Ca++) o sobre la unión de ligandos en la membrana celular [6Liboff 1985, 7Chiabrera 1985, 8Lednev
1991, 9Blanchard 1994].
La posibilidad de variaciones influyentes del metabolismo del Ca++ puede conducir a apoptosis celular (muerte
celular programada) [10Preston, 11Trump 1997]
Otro mecanismo de interacción física se relaciona con la posibilidad de influir en la cinética de rutas de señalización
celular apropiadas de la célula (incluyendo el metabolismo del calcio) a través de un efecto directo de campo sobre el
movimiento de espín electrónico de átomos y moléculas con electrones desapareados. Esta influencia puede afectar a la
razón de recombinación de un par de radicales libres correlacionado con el espín y en consecuencia en la señalización
redox [12Grundler 1992; 13Polk 1992; 14Walleczek y Budingher 1992, 15Adey 1993].
En particular, la transición de nivel energético singlete-triplete del espín en un radical libre es crítica para aumentar
la razón de recombinación de pares de radicales libres correlacionados con el espín.
Se conoce la posibilidad de que campos magnéticos S y ELF de bajo nivel, no térmicos (con intensidad de hasta
30 mT) influyan in vitro en la cinética y eficacia de reacciones de pares de radicales a partir de la magnetoquímica
[
16Steiner 1989].
Los radicales libres que se producen de manera natural tienen un electrón desapareado basado en oxígeno o nitró-
geno tal como el anión superóxido, el radical hidroxilo y el óxido nítrico. Estas especies reactivas de oxígeno (ROS)
y especies reactivas de nitrógeno (RNS) pueden seleccionar como objetivo proteínas proporcionando una explicación
mecanística obvia para los acontecimientos de señalización mediados por radicales libres. Estos acontecimientos
pueden influir en los factores de crecimiento, transporte iónico (es decir, canales de Ca++), transcripción, apoptosis
[
17Lander 1997].
La apoptosis es una forma morfológicamente distinta de muerte celular programada que está conectada a procesos
de supervivencia celular que desempeñan un importante papel durante el desarrollo, la homeostasis y en muchas
enfermedades incluyendo cáncer, síndrome de inmunodeficiencia adquirida y trastornos neurodegenerativos, así como
en otras enfermedades que de manera similar a éstas, se caracterizan por procesos de supervivencia celular alterados.
La apoptosis se produce a través de la activación de un programa suicida intrínseco de la célula. El mecanismo genético
básico de la apoptosis parece estar presente esencialmente en todas las células de mamífero en todo momento, pero la activación de este programa suicida está regulada por muchas señales diferentes que se originan a partir del entorno
tanto intracelular como extracelular.
Entre todos los genes implicados en la regulación de la apoptosis, el gen p53 está recibiendo mucha atención.
Este gen, que codifica para un factor de transcripción y es común en muchos cánceres humanos, media las respuestas
celulares frente a cierto daño ambiental. La proteína p53 o bien puede detener temporalmente la división celular, de
modo que la célula puede reparar el ADN alterado, o bien puede dirigir a la célula a una muerte apoptótica.
Los datos publicados apoyan que p53 aparece en la apoptosis a través de un proceso de tres etapas: 1) inducción
transcripcional de genes relacionados con redox; 2) la formación de especies reactivas de oxígeno y 3) la degradación
oxidativa de componentes mitocondriales, culminando en la muerte celular [18Polyak 1997].
Además, se combinan agentes antioxidativos con fármacos en el tratamiento de células tumorales con hipoxia
19 [Walch, 1988] y en la influencia del factor de crecimiento vascular 20 [Amirkhosravi, 1998].
Además, los datos publicados están apoyando la idea de que las células patológicas responden de manera diferente
a las células normales a los estímulos de campos ELF. Según 21Cadossi [1992], los linfocitos de pacientes normales
responden de manera diferente a los linfocitos de los pacientes con síndrome de Down, SIDA y leucemia linfocítica
crónica cuando se exponen a campos ELF (previamente con mitógeno).
También se reconoce que el flujo de entrada de Ca++ a través de la membrana está influido por campos ELF en
linfocitos leucémicos pero no en linfocitos normales [22Walleczek, 1998].
Los procesos de supervivencia celular alterados vienen con trastornos eléctricos y comportamiento eléctrico diferente.
De hecho, las células que proliferan rápidamente y transformadas tienen membranas celulares eléctricamente
despolarizadas si se comparan con las células normales [23Bingelli, 1986; 24 Marino, 1994]. También se ha demostrado
que las células epiteliales pierden su potencial transepitelial durante la carcinogénesis [25Davies 1987; 26 Goller
1986; 27 Capko 1996]. Este comportamiento eléctrico diferente de las células tumorales comparado con células normales
es la base de una modalidad diagnóstica del cáncer recién propuesta [28Cuzick 1998]. Además, la concentración
de radicales libres en las células y tejidos transformados es superior a en los no transformados [29Szatrowski 1991;
30 Shulyakovskaya, 1993; 31 Iwagaki 1995].
Con referencia a la quimioterapia, todos los esfuerzos se dedican al objetivo de inducir la apoptosis celular in
vivo en lugar de destruirlas, a través de terapia dirigida a la transducción de señales (STDT) del cáncer [32Levin,
1998].
La transducción de señales es un término funcional que connota la traducción de la información genética en las
cascadas de señalización que permiten a la célula, por ejemplo, interpretar y responder a estímulos externos y/o a
duplicarse ella misma. Evidencias recientes sugieren que las alteraciones en los procesos de supervivencia celular
contribuyen a la patogénesis de varias enfermedades humanas, incluyendo cáncer, infecciones víricas, enfermedades
autoinmunitarias, trastornos degenerativos y SIDA. Los tratamientos diseñados para alterar específicamente el umbral
apoptótico conectado con los mecanismos de los procesos de supervivencia pueden tener la posibilidad de cambiar la
progresión natural de algunas de estas enfermedades [33Thompson, 1995].
Se han utilizado campos magnéticos, electromagnéticos y eléctricos de alta intensidad para destruir células patológicas.
En el documento 34US4665898, se describe un aparato en el que se tratan animales que tienen células malignas
por medio de un campo magnético pulsado de alta intensidad, con el fin de neutralizar/destruir células malignas de
manera selectiva. Este aparato produce campos magnéticos térmicos que tienen una intensidad comprendida entre 1
Tesla y hasta 10 Tesla y una polaridad de inversión en el intervalo de 5+1000 kilohertzios. En la realización preferida,
se establece la intensidad del campo magnético entre 1 y 50 Tesla y, en particular, en el ejemplo, se establece en 5
Tesla y 8 kilohertzios hasta 18 Tesla y 250 kilohertzios.
Se han utilizado diferentes campos ELF, térmicos, continuos o pulsados, para la terapia anticancerígena in vitro
[
35Narita, 1997; 36Raylman, 1996].
En estos casos los campos son de intensidad muy alta, mucho mayor de la que se permite que se expongan las
personas por las normas de seguridad y pueden producir calentamiento dañando así tejidos y células normales.
Los campos electromagnéticos ELF de baja intensidad se han utilizado también para inhibir la mitosis de células
malignas, tal como en los documentos DE-A-4122380 y US-A-5156587. Sin embargo, este último documento describe
el uso de campos sinusoidales sólo a una frecuencia neta fija y a una intensidad fija, con la posibilidad de barrer
solamente un intervalo limitado de niveles de energía dentro del tejido celular. El documento DE-A-4 122 380 describe
un aparato según el preámbulo de la reivindicación 1.
Sumario de la invención
Es un objeto de la presente invención, que se define en la reivindicación 1, proporcionar un aparato para interferir
en los procesos de supervivencia celular (es decir, para inducir apoptosis) de células patológicas vivas (es decir, células
cancerígenas) mediante el uso campos magnéticos sin afectar adversamente a las células normales.
El anterior y otros objetos se alcanzan interfiriendo en la supervivencia de células patológicas según la invención,
cuya característica es aplicar a células patológicas vivas (es decir, células cancerígenas y células afectadas por otras
enfermedades producidas por alteraciones en el mecanismo de la supervivencia celular) campos magnéticos SELF no
térmicos para inducir la apoptosis de manera selectiva.
Para los fines de la invención, los campos SELF han de considerarse como diferentes secuencias de campos S y/o
ELF, es decir campos S seguidos por campos ELF, campos ELF seguidos por campos S y campo S y ELF juntos, así
como la presencia de campos S o ELF solos.
El concepto que subyace a la invención es que los campos SELF interfieren en la señalización celular que sostiene
el comportamiento patológico celular en el interior de células patológicas, es decir, en la señalización redox a través de
radicales libres, restableciendo así los procesos de supervivencia celular, es decir, induciendo directa o indirectamente
la apoptosis a través de una modificación de la expresión del gen p53.
Este método se supone que recombina radicales libres basados en oxígeno y también puede utilizarse como agente
antioxidativo. También puede considerarse su combinación con fármacos en el tratamiento de células tumorales con
hipoxia y en la influencia del factor de crecimiento vascular.
El motivo por el que los campos SELF inducen selectivamente la apoptosis en células patológicas (es decir, células
cancerígenas) puede relacionarse con el comportamiento eléctrico alterado de las células patológicas comparado con
el de las células normales.
Por estos motivos, los campos SELF pueden inducir directa o indirectamente una muerta celular programada por
señal (apoptosis), in vitro e in vivo, sin producir ningún efecto adverso.
En la hipótesis de que la recombinación de radicales libres está en la base de los efectos biológicos esperados
sobre las células patológicas(es decir, actividad antitumoral), ha de considerarse la transición entre singlete-triplete
de un electrón desapareado en radicales libres basados en oxígeno. De hecho esta transición, que depende del campo
magnético aplicado, es crítica para aumentar la razón de recombinación de un par de radicales libres correlacionados
con el espín. Sin embargo, se desconocen los centros de reacción relacionados con el efecto antitumoral esperado y,
por tanto, no pueden determinarse con precisión la vida de los estadios de espín y la separación de energía entre los
estados singlete y triplete a partir del hamiltoniano de espín [37Haberkorn 1979, 38 Lersch 1983].
Para abarcar este problema, según la invención, pueden utilizarse secuencias de campos magnéticos S de diferente
intensidad modulados en amplitud, con la superposición de campos magnéticos ELF. El uso de campos modulados
está de acuerdo con la necesidad de alcanzar condición(ones) óptima(s) para la conversión del estado de espín singletetriplete
requerida para los procesos de recombinación de radicales libres [13 Polk 1992].
Por estos motivos, los campos S, ELF o SELF tienen mayor probabilidad para inducir los efectos biológicos
esperados si se modulan siguiendo una función predeterminada de intensidad y/o frecuencia frente al tiempo, dado
que de esta manera la probabilidad de inducir la transición anterior es superior.
Las diferentes secuencias de secuencias de campos S y/o ELF se establecen ventajosamente para intervalos de
tiempo T1, T2, ..., Tn, en los que la intensidad IS, IELF y su razón IS/IELF se establecen en valores estacionarios IS1,
IS2, ..., ISN; IELF1, IELF2, ..., IELFn, IS1/IELF1, IS2/IELF2, ..., ISn/IELFn, respectivamente.
Por los mismos motivos, pueden utilizarse potencialmente campos no térmicos SELF modulados para el tratamiento
de células afectadas por muchas enfermedades tales como infecciones víricas, enfermedades autoinmunitarias, etc.,
en las que la alteración de la supervivencia celular contribuye a su patogénesis.
Según otro aspecto de la invención, un aparato para interferir selectivamente en los procesos de supervivencia
de células patológicas in vitro e in vivo tiene la característica de comprender medios para generar campos magné-
ticos estáticos (S) que cruzan un entorno de trabajo y medios para generar campos electromagnéticos de frecuencia
extremadamente baja (ELF) en el entorno de trabajo solos o además de los campos S.
Se proporcionan medios para modular los campos S asociados a los medios para generar campos S y que varían la
intensidad de los campos S entre 1 y 100 mT y preferiblemente desde 1 hasta 30 mT.
También se proporcionan medios para modular los campos ELF solos o asociados a los campos S a una frecuencia
entre 1 y 1000 Hz con una intensidad comprendida entre 1 y 30 mT. Preferiblemente, los campos ELF tienen una
frecuencia de entre 10 y 100 Hz.
En una realización particular de la invención, los medios para modular los campos S comprenden medios de
programa que alternativamente o en combinación:
- establecen la intensidad tras una pluralidad de valores de etapa predeterminados IS1, IS2, ..., ISN para los
correspondientes intervalos de tiempo T1, T2, ..., Tn;
- establecen la amplitud de la intensidad tras una pluralidad de valores de etapa predeterminados IELF1, IELF2,
..., IELFn para los correspondientes intervalos de tiempo T1
, T2
, ..., Tn
;
- establecen la frecuencia tras una pluralidad de valores de etapa predeterminados f1, f2, ..., fn, para los
correspondientes intervalos de tiempo T1, T2, ..., Tn;
- establecen una razón S/ELF según una pluralidad de valores de etapa predeterminados IS1/IELF1, IS2/IELF2, ...,
ISn/IELFn para los correspondientes intervalos de tiempo T1, T2, ..., Tn.
Preferiblemente, los medios de programa establecen los campos S y ELF según una intensidad global entre 1 y 30
mT, y respectivamente una razón de S/ELF comprendida entre 0,1 y 10 y, en una realización particularmente preferida,
según una intensidad global entre 1 y 10 mT y respectivamente, una razón de S/ELF comprendida entre 0,5 y 5.
Los intervalos de tiempo se establecen preferiblemente entre 1 y 40 minutos.
Al menos una parte del entorno de trabajo está definida por paredes permeables a los campos S y ELF. Al menos
una parte del entorno de trabajo está también ventajosamente adyacente a unas primera y segunda bobinas, respectivamente,
y los medios para modular el suministro a las bobinas de corriente CC y CA, respectivamente.
Breve descripción de los dibujos
Se muestran varias realizaciones del aparato en los dibujos adjuntos, facilitados como ejemplo y no limitativos, en
los que:
- la figura 1 muestra una vista esquemática de una primera realización de un aparato según la invención;
- las figuras 2 a 4 muestran diagramas de bloques de una segunda, tercera y cuarta realización de un aparato según
la invención, respectivamente;
- la figura 5A muestra una función esquemática de la intensidad de campo frente al tiempo, programable en el
aparato según la invención;
- la figura 5B muestra una función esquemática de la intensidad de campo de los campos S y ELF frente al tiempo,
variando también la razón con respecto a cada campo;
- la figura 5C muestra una función esquemática de la intensidad de campo y la frecuencia frente al tiempo.
Descripción del aparato preferido
En la figura 1, el entorno de trabajo se indica como 1 y la pared como 2. A las primera y segunda bobinas se les
facilitan los números de referencia 3 y 4, respectivamente. Los medios de modulación se indican esquemáticamente
mediante los recuadros 5 y 6 respectivamente, y están conectados a fuentes de CC y CA.
En la figura 2, una realización diferente del aparato, utilizado para interferir en la supervivencia de células patológicas
tanto in vitro como in vivo tiene dos bobinas 23 y 24 localizadas coaxiales entre sí en los lados opuestos del
entorno 21 de trabajo. Se proporcionan transformadores 25 y 26 variables conectados a una red 27 eléctrica de CC de
50 Hz. Se proporcionan puentes 28 de diodo conmutables para cambiar el suministro de CA a las bobinas. Se proporcionan
un transformador 29a de CC, un rectificador 29b así como un temporizador 29c suministrando dos placas 29
de modo que puede crearse un campo eléctrico estático de hasta 20 kV/m (o de baja frecuencia variable hasta 1000
Hz) y preferiblemente de aproximadamente 6 kV/m, en el entorno 21 de trabajo dentro de intervalos preferidos, según
las condiciones experimentales.
En la figura 3 se muestra una realización adicional del aparato utilizado para interferir en la supervivencia de células
patológicas in vitro que tiene un modulador 35 de SELF (1-100 Hz) y dos bobinas 33 y 34 localizadas coaxiales entre
sí en los lados opuestos del entorno 31 de trabajo. Se utiliza un amplificador 36 entre el modulador 35 y las bobinas 33
y 34, a los que se suministra la misma corriente que crea en el entorno 31 un campo magnético o bien S o bien ELF.
Otra realización del aparato según la invención (figura 4) utilizado para interferir en la supervivencia de células
patológicas tanto in vitro como in vivo tiene dos bobinas 43 y 44 de Helmoltz localizadas coaxiales entre sí en los
lados opuestos del entorno 41 de trabajo. Se utiliza un amplificador 46 entre el modulador 45 y las bobinas 43 y 44, a
través de un elemento 47 de derivación, que también está conectado a un ordenador 49 personal.
Cada aparato puede utilizarse para producir campos SELF no térmicos modulados para interferir en la supervivencia
de células patológicas.
Con referencia a las figuras 5A a 5C, se facilita un ejemplo de la programación del aparato en el que se lleva a cabo
la modulación de la intensidad, frecuencia y razón de intensidad entre los campos S y ELF.
En la figura 5A, la manera en que varía la intensidad I frente al tiempo. I1, I2, I3, In son la intensidad o la intensidad
de campo (mT) de o bien el campo S o bien del campo ELF, o bien la intensidad global es IS + IELF.
En la figura 5B, cuando ambos campos S y ELF están presentes, es posible modular no sólo su intensidad o
amplitud de intensidad, sino también su razón IS/IELF. Por ejemplo, pueden utilizarse diferentes razones 1; 1,5; 2, etc.
durante intervalos de tiempo T1, T2; T3; etc.
También puede modularse la frecuencia tal como se muestra en la figura 5C. La frecuencia también puede modularse
en dos o más intervalos que se siguen T1, T2, en los que se aplica la misma intensidad I1−2.
Partiendo de los ejemplos básicos de las figuras 5A-5C, puede producirse una secuencia de campos S, ELF, S+ELF
modulados que también pueden repetirse cíclicamente.
El método según la invención se describirá ahora con más detalles a modo de ejemplos específicos.
Ejemplo 1
En este experimento, se estudió in vitro la capacidad de inducir apoptosis mediante un campo magnético SELF
como una función de la frecuencia y la intensidad de campo.
Se utilizó la línea celular de adenocarcinoma de colon humano (WiDr) cultivada en monocapas confluentes en
matraces T25, para el experimento. Para cada condición de exposición, se utilizaron 6 matraces que contenían cada
uno aproximadamente 10 millones de células, 3 expuestos y 3 expuestos de manera fingida (es decir, no expuestos).
Durante la exposición, se mantuvieron los matraces entre dos bobinas conectadas a un circuito que proporcionaba
corrientes CC y CA de hasta 100 hertzios. Se monitorizó continuamente la temperatura y se mantuvo en 37 ± 0,2ºC.
La duración de la exposición fue de 20 minutos para cada experimento y se mantuvo el campo SELF constante.
Después de 3 horas, se trataron las células con tinción de May-Grunwald-Giemsa. Se evaluó la apoptosis contando el
número de núcleos apoptóticos por 10 campos de alta potencia (HPF) utilizando un microscopio óptico.
Se evaluó la cantidad de apoptosis inducida mediante la razón entre el número de células apoptóticas encontradas
en el grupo expuesto y el número de células apoptóticas encontradas en el grupo expuesto de manera fingida, es decir
el grupo no expuesto a los campos magnéticos según la invención.
La tabla 1 notifica los resultados obtenidos en diferentes condiciones de exposición.
TABLA 1
TABLA 1 (continuación)
Todos los resultados fueron estadísticamente muy significativos (en la prueba de la t de Student). A partir de la
tabla 1, puede observarse que el efecto de apoptosis aparece a 2 mT y se dobla a partir de 3 mT.
Otro hallazgo importante es que la apoptosis no depende de la frecuencia del campo SELF. En otras palabras,
durante la duración del mecanismo que opera el efecto biológico (apoptosis) el campo ELF se considera como esencialmente
constante. Esto significa que entre los dos mecanismos planteados como hipótesis, el mecanismo de tipo
radicales libres (que se produce en una escala de tiempos de nano a microsegundos) y el de resonancia iónica, el de
radicales libres es el que desempeña el papel [39Scaiano, 1994, 40Engstrom, 1997].
Ejemplo 2
En este experimento, se verificó el efecto selectivo de campos magnéticos SELF exponiendo tres líneas celulares.
Dos líneas eran malignas, células de adenocarcinoma de colon humano (WiDr) y células de cáncer de mama humano
(MCF-7). La línea celular normal era de fibroblastos de pulmón humano (MRC-5).
Como en el ejemplo 1, se cultivó cada línea células en monocapas confluentes en matraces T25. El protocolo
experimental fue el mismo que en el ejemplo 1. Se expusieron seis matraces (3 expuestos y 3 expuestos de manera
fingida) para cada línea celular durante 20 minutos. Se evaluó la apoptosis tras 3 horas. Las condiciones de exposición
utilizadas fueron el tipo R de la tabla 1.
Se notifican los resultados en la tabla 2.
TABLA 2
Tal como se muestra en la tabla 2, sólo las células cancerígenas notificaron un aumento de la apoptosis estadísticamente
muy significativo, mientras que la línea celular normal no lo hizo. La diferencia en el porcentaje de apoptosis
entre las dos líneas de células cancerígenas se esperaba debido a los dos tiempos de duplicación diferentes. De hecho,
WiDr se duplica más rápidamente que MCF-7. Se evaluaron los resultados en la prueba de la t de Student.
Ejemplo 3
En este ejemplo, se utilizaron ratones desnudos (nu/nu) que llevan masas tumorales subcutáneas para evaluar la
influencia de los campos magnéticos SELF sobre la inhibición del crecimiento tumoral.
Cada ratón se inoculó por vía subcutánea con 10 millones de células de adenocarcinoma de colon humano (WiDr).
Se llevaron a cabo dos experimentos sucesivamente.
En el primer experimento, se asignaron aleatoriamente 36 ratones hembra a 4 grupos experimentales, cada uno formado
por 6 expuestos y 3 expuestos de manera fingida para un total de 24 animales expuestos a 4 campos magnéticos
SELF diferentes y 12 expuestos de manera fingida.
También se aplicó un campo eléctrico estático de hasta 6 kV/m para aprovecharse eventualmente del diferente
comportamiento eléctrico entre los tejidos normales y tumorales [41Thornton, 1984; 42Barsamian, 1987].
En el segundo experimento, se asignaron aleatoriamente 24 ratones hembra a 2 grupos experimentales, formados
por 12 expuestos a la condición de exposición a SELF que dio los mejores resultados entre las cuatro condiciones
de exposición utilizadas en el experimento anterior (condición de exposición número 4) y 12 expuestos de manera
fingida.
Se dividieron todos los ratones de ambos experimentos en los grupos experimentales tras ser palpables las masas
tumorales para cada animal.
Se expusieron los animales durante 70 minutos, una vez al día durante 5 días a la semana, durante 4 semanas.
Durante la exposición se puso cada ratón en una caja individual compuesta por Plexiglas mantenida entre las dos
bobinas conectadas a un circuito que proporciona corriente CC y CA hasta 100 Hz, respectivamente.
Se mantuvieron los ratones desnudos en condiciones específicas libres de patógenos y se les suministró una dieta a
voluntad. Se realizaron todas las pruebas según el protocolo emitido por el N.I.H. (Instituto Nacional de Salud de los
EE.UU.) y el N.C.I. (Instituto Nacional del Cáncer de los EE.UU.).
Se midieron las masas tumorales dos veces a la semana y se calculó su volumen en mm3
según la fórmula:
[(diametro mayor) x (di ´ ametro menor al cuadrado)] ´ /2
Después de 4 semanas, se sacrificaron los animales y se les realizó la autopsia. Se extrajeron las masas tumorales,
se pesaron y se midieron. Se utilizaron partes de los tumores para diferentes análisis, es decir,
- inmunohistoquímico: antígeno Ki-67 para determinar el índice proliferativo, antígeno p-53 para determinar
la expresión del gen p-53;
- histopatológico: tinción con hematosilina-eosina para la evaluación del número de mitosis;
- ultraestructural: microscopía electrónica;
- hibridación de ácidos nucleicos: método tunel para la evaluación de la apoptosis.
Además, se extrajeron los siguientes órganos de cada animal para su examen histológico para evaluar la toxicidad
del tratamiento: cerebro, corazón, riñones, hígado, pulmones, ganglios linfáticos axilares e inguinales, ganglios
linfáticos mediastínicos, ovarios, piel, bazo, médula ósea, tejido subcutáneo (sitio de implantación de la línea celular
tumoral) así como pruebas sanguíneas.
Los resultados obtenidos se notifican en la tabla 3 para el primer experimento y en la tabla 4 para el segundo.
TABLA 3
TABLA 3 (continuación)
TABLA 4
Los datos notificados en las tablas 3 y 4 muestran que los campos SELF tienen un efecto inhibidor del crecimiento
tumoral in vivo. Este efecto, encontrado en ambos experimentos, fue estadísticamente muy significativo (en el primer
experimento, principalmente para la condición de exposición 4) en las pruebas de Dunnet y de la t de Student,
respectivamente.
En el examen histológico de 12 órganos para cada animal de todos los grupos, no se encontraron diferencias
entre los ratones expuestos y los expuestos de manera fingida. Tampoco se encontraron diferencias en las pruebas
sanguíneas. Estos hallazgos prueban la ausencia de toxicidad relacionada con el tratamiento con campos SELF.
El análisis ultraestructural mediante microscopía electrónica mostró en las células tumorales de los animales expuestos
muchas alteraciones celulares: presencia de cuerpos apoptóticos y cromatina condensada cerca de la membrana
nuclear, característico de acontecimientos apoptóticos.
Además, un resultado sistemático está representado por modificaciones morfológicas, aumento del número y dimensiones
de las mitocondrias asó como del número de nucleolos, presencia de muchas vacuolas dentro del citoplasma.
Las células no neoplásicas (es decir, células epiteliales y estromales) no mostraron diferencias entre los animales
expuestos y los expuestos de manera fingida de acuerdo con la ausencia de toxicidad encontrada en 12 órganos normales
examinados en cada animal.
El aumento en la apoptosis así como la disminución en la expresión del gen p53 encontrados en los tumores de los
ratones expuestos (véanse las tablas 3 y 4) fueron estadísticamente muy significativos (prueba de la t de Student).
Los resultados notificados en las tablas 3 y 4 están de acuerdo con los obtenidos in vitro y mostrados en las tablas
1 y 2.
El efecto inducido por los campos magnéticos SELF sobre la expresión de p53 hace valer los resultados de la
apoptosis y está de acuerdo con el mecanismo biofísico planteado como hipótesis (es decir, recombinación de radicales
libres) mediante el cual los campos SELF tienen un efecto antitumoral a través de la formación de especies reactivas
de oxígeno y la degradación de los componentes mitocondriales.
Ejemplo 4
En este experimento, se expusieron ratones desnudos (nu/nu) inoculados previamente por vía subcutánea con 10
millones de células de adenocarcinoma de colon humano (WiDr) para estudiar la supervivencia del animal.
Tras la inoculación celular, se formaron aleatoriamente 2 grupos de ratones, respectivamente de 16 animales expuestos
y 17 expuestos de manera fingida. Los ratones del primer grupo se expusieron 70 minutos una vez al día,
durante 5 días a la semana; durante toda su vida comenzando 24 horas tras la inoculación tumoral.
Las condiciones de exposición fueron las mismas del experimento cuyos resultados se notifican en la tabla 4.
Como en el ejemplo previo, se mantuvieron los ratones en condiciones específicas libres de patógenos suministrados
con una dieta a voluntad. Se realizaron todas las pruebas según el protocolo emitido por el N.I.H. y el N.C.I.
Se evaluó la eficacia antitumoral del tratamiento utilizando la fórmula del N.C.I.: razón entre los animales expuestos
y expuestos de manera fingida de la duración de la vida media del animal. Esta media se evaluó sumando para cada
grupo experimental el tiempo de supervivencia dividido entre el número de animales. Se obtiene eficacia cuando la
fórmula del N.C.I. da como resultado un índice igual o superior a 1,25.
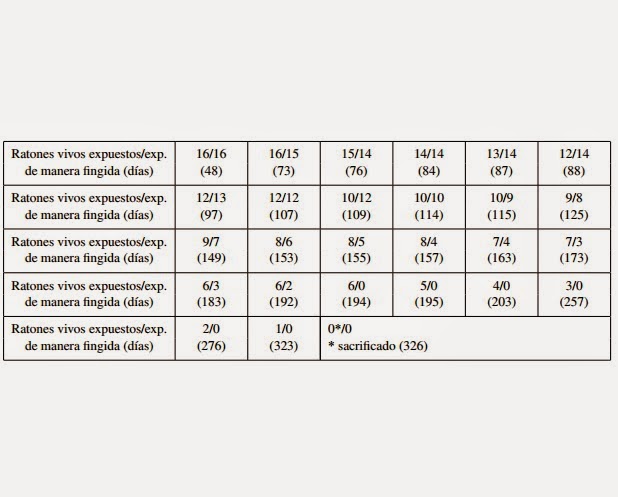
La tabla 5 notifica para cada grupo experimental, el número de animales vivos a diferentes tiempos (días) desde el
comienzo del experimento.
TABLA 5
La fórmula del N.C.I. aplicada a los resultados notificados en la tabla 5 da un índice igual a 1,31, que es superior
a 1,25. Después de 194 días, 6 ratones expuestos estaban vivos mientras que los ratones expuestos de manera fingida
estaban muertos.
La descripción anterior de las realizaciones específicas describirá la invención según el punto de vista conceptual,
de modo que otros, aplicando el conocimiento actual, podrán modificar y/o adaptar para diversas aplicaciones tales
realizaciones sin investigación adicional y sin apartarse de la invención. Los medios y los materiales para realizar las
diferentes funciones descritas en el presente documento podrían tener una naturaleza diferente sin, por este motivo,
apartarse del campo de la invención.
REIVINDICACIONES
1. Aparato para interferir selectivamente en procesos de supervivencia de células patológicas in vitro e in vivo que
comprende:
- medios para generar uno o una combinación de:
campos magnéticos estáticos (campos S), en los que dichos campos S tienen una intensidad comprendida
entre 1 y 100 mT, y
campos electromagnéticos de frecuencia extremadamente baja (campos ELF), en los que dichos campos
ELF tienen una intensidad de entre 1 y 100 mT y una frecuencia de entre 1 y 1000 Hz;
- medios para modular dichos campos S y ELF asociados a dichos medios para generar los campos, estableciendo
dichos medios para modular dichos campos la intensidad de dichos campos S y ELF según una función predeterminada
de intensidad frente al tiempo,
caracterizado porque los medios para modular dicho campo S y ELF comprenden medios de programa que establecen
dicha intensidad de dichos campos S y ELF en una pluralidad de valores de etapa de intensidad predeterminados
para los correspondientes intervalos de tiempo T1
, T2
, ..., Tn
.
2. Aparato según cualquiera de las reivindicaciones 1 ó 3, en el que en presencia de campos ELF dichos medios
para modular dichos campos ELF comprenden medios de programa que establecen dicha frecuencia tras una pluralidad
de valores de etapa predeterminados f1, f2, ..., fn para los correspondientes intervalos de tiempo T1, T2, ..., Tn, estando
comprendidos dichos valores de etapa entre 10 y 100 Hz.
3. Aparato según la reivindicación 1, en el que en presencia de ambos campos S y ELF dichos medios para
modular comprenden medios de programa que establecen una razón de S/ELF según una pluralidad de valores de
etapa predeterminados IS1/IELF1, IS2/IELF2, ..., ISn/IELFn, para los correspondientes intervalos de tiempo T1, T2, ..., Tn.
4. Aparato según la reivindicación 3, en el que dichos medios de programa establecen dichos campos S y ELF
según una intensidad global entre 1 y 30 mT y respectivamente una razón de S/ELF comprendida entre 0,1 y 10.
5. Aparato según la reivindicación 3, en el que dichos medios de programa establecen dichos campos S y ELF
según una intensidad global entre 1 y 10 mT y respectivamente una razón de S/ELF comprendida entre 0,5 y 5.
6. Aparato según las reivindicaciones anteriores, en el que dichos medios de programa establecen dichos intervalos
de tiempo entre 1 y 40 minutos.
7. Aparato según las reivindicaciones anteriores, en el que al menos una parte de dicho entorno de trabajo está
definido por paredes permeables a dichos campos.
8. Aparato según las reivindicaciones anteriores, en el que dichos medios para generar dichos campos S y/o ELF
comprenden al menos unas primera y segunda bobinas rodeando respectivamente al menos una parte de dicho entorno
de trabajo, proporcionando dichos medios para modular a dichas bobinas corriente CC y/o CA, respectivamente.
9. Aparato según las reivindicaciones 1 a 7, en el que dichos medios para generar dichos campos S y/o ELF
comprenden al menos unas primera y segunda bobinas coaxiales entre sí, estando situado dicho entorno de trabajo
entre dichas primera y segunda bobinas y proporcionando dichos medios para modular a dichas bobinas corriente CC
y/o CA, respectivamente.
10. Aparato según las reivindicaciones anteriores, en el que se proporcionan medios para crear a través de dicho
entorno de trabajo un campo S o un campo ELF que tiene una intensidad de hasta 20 kV/m.
Bibliografía
1 Blank M (1993): “Electricity and Magnetism in Biology and Medicine”. The First World Congress for Electricity
and Magnetism in Biology and Medicine (primer Congreso Mundial para Electricidad y Magnetismo en Biología y
Medicina), Orlando, Florida.
2 Liboff AR, Williams T Jr, Strong DM and Wistar R. Jr. (1984): “Time-Varying Magnetic Fields: Effect on DNA
Synthesis”. Science, Vol. 223, págs. 818-820.
3 Tofani S, Ferrara A, Anglesio L, Gilli G (1995): “Evidence for genotoxic effects of resonant ELF magnetic
fields”. Bioelectrochemistry and Bioenergetics 36, págs. 9-13.
4 Goodman R, Shirley Henderson A (1991): “Transcription and Translation in Cells exposed to Extremely Low
Frequency Electromagnetic Fields” Bioelectrochem. Bioenerg. 25, págs. 335-355.
5 Phillips jl, Haggren w, Thomas WJ, Ishida-Jones T and Adey WR (1992):“Magnetic field-induced changes in
specific gene transcription”. Biochimica et Biophysica Acta 1132, págs. 140-144.
6 Liboff AR (1985): Cyclotron resonance in membrane transport. En Chiabrera A, Nicolini C., Schwan HP (eds):
“Interactions Between Electromagnetic Fields and Cells”. Nueva York: Plenum Press, págs. 281-296.
7 Chiabrera A., Grattarola M., Viviani R. (1984): “Interaction between electromagnetic fields and cells: Microelectrophoretic
effect on ligands and surface receptors”. Bioelectromagnetics 5, págs. 173-191.
8 Lednev VV (1991): “Possible mechanism for the influence of weak magnetic fields on biological systems”.
Bioelectromagnetics 12, págs. 71-75.
9 Blanchard JP, Blackman CF (1994):“Clarification and application of an ion parametric resonance model for
magnetic field interactions with biological systems. Bioelectromagnetics 15, págs. 217-238.
10 Preston GA, Barrett JC, Biermann JA and Murphy Elizabeth (1997): “Effects of Alterations in Calcium
Homeostasis on. Apoptosis during Neoplastic Progression”, Cancer’ Research 57, págs. 537-542.
11 Trump BF, Berezesky IK, Chang SH and Phelps PC (1997):“The Pathways of Cell Death: Oncosis, Apoptosis,
and Necrosis”. Toxicologic Pathology Vol. 25, n. 1, págs. 82-87.
12 Grundler W, Kaiser F, Keilmann F, Walleczek J (1992): “Mechanisms of electromagnetic interaction with
cellular systems”. Naturwissenschaften 79, págs. 551-559.
13 Polk C (1992): “Dosimetry of extremely-low-frequency magnetic fields”. Bioelectromagnetics Supl 1, págs.
209-235
14 Walleczek J, Budinger TF (1992): “Pulsed magnetic field effects on calcium signalling in lymphocytes: Dependence
on cell status and field intensity”. FEBS Lett 314, págs. 351-355.
15 Adey WR (1993): Electromagnetics in biology and medicine. En Matsumoto H (ed): “Modern Radio Science”,
Nueva York: Oxford University Press, págs. 227-245.
16 Steiner UE and Ulrich T (1989):“Magnetic Field Effects in Chemical Kinetics and Related Phenomena” Chem.
Rev. 89, págs. 51-147.
17 Lander HM (1997):“ An essential role for free radicals and derived species in signal transduction”. The FASEB
Journal 11, págs. 118-124.
18 Polyak K, Xia Y, Zweier JL, Kinzier KW and Volgestein B (1997): “A model for p53-induced apoptosis”.
Nature Vol. 389, págs. 300-305.
19 (18). Walch, N.S., Calaoagan, J., Murphy, B.J., Knapp, A.M., Sutherland, R.M., Laderoute, K.R. “The
redox-sensitive human antioxidant responsive element induces gene expression under low oxygen conditions”. Carcinogenesis,
19 (8): 1333-7, 1988.
20 Amirkhosravi, A., Meyer, T., Warnes, G., Amaya, M., Malik, Z., Biggerstaf, J.P., Siddiqui, F.A., Sherman,
P., Francis, J.L. Pentoxifylline inhibits hypoxia-induced upregulation of tumor cell tissue factor and vascular endothelial
growth factor. Thromb Haemost, 80 (4): 598-602, 1998.
21 Cadossi R, Bersani F, Cossarizza A, Zucchini P, Emilia G, TorelliGand Claudio Franceschi (1992):“Lymphocytes
and low-frequency electromagnetic fields”. The FASEB Journal Vol. 6, págs. 2667-2674.
22 Walleczeck J (1996): “Electromagnetic Field Effects on Cellular Signal Transduction and Free Radical Mechanisms”.
Abstract Book XXVth General Assembly of the International Union of Radio Science (Libro resumen de la
XXV Asamblea General de la Unión Internacional de Radio Science)-Lille-Francia, pág. 547.
23 Binggeli R, Weinstein RC. Membrane potentials and sodium channels: hypotheses for growth regulation and
cancer formation based on changes in sodium channels and gap junctions. Theor Biol 1986: 123:377-401.
24 Marino AA, Iliev IG, Schwalke MA, Gonzales E, Marler KC, Flanagan CA. Association between cell membrane
potential and breast cancer Tumour Biol. 1994: 15:82-89.
25 Davies RJ, Weidema WF, Sandle GI, Palmer LI, Deschener EE, DeCosse JJ. Sodium transport in a mouse
model of colonic cancer. Cancer Res. 1987: 47:4646-50.
26 Goller DA, Weidema WF, Davies RJ. Transmural electrical potential as an early marker in colon cancer. Arch.
Surg. 1986: 121:345-50.
27 Capko D, Zhuravkov A, Davies RJ. Transepithelial depolarisation in breast cancer. Breast Cancer Res. 1996:
Treat. 41:230.
28 Cuzick J, Holland R., Barth V, Davies R, Faupel M, Fentiman I, Frischbier HJ, LaMarque JL, Merson M,
Sacchini V, Vanel D, Veronesi U. Electropotential measurements as a new diagnostic modality for breast cancer. The
Lancet 1998: 352:359-363.
29 Szatrowski TP, Nathan CF. Production of of large amounts of hydrogen peroxide by human tumor cells. Cancer
Res. 1991: 51 (3):794-798.
30 Shulyakovskaya T, Sumegi L, Gal D. In vivo experimental studies on the role of free radicals in photodynamic
therapy. I. measurement of the steady state concentration of free radicals in tumor tissues of mice. Biochem. Biophys.
Res. Commun. 1993: 195 (2):581-587.
31 Iwagaki H, Hamazaki K, Matsubara N, Hiramatsu M, Orita K, Mori A..Lipid peroxidation in hepatocellular
carcinoma. Acta Med. Okayama 1995: 49 (6):313-315.
32 Levin VA (1998):“Signal Transduction Directed Therapy: Fact or Fantasy?” Abstract Book (EL 5) of the Eight
International Congress on Anti-Cancer Treatment (Libro resumen (EL 5) del octavo Congreso Internacional sobre
Tratamiento Anticancerígeno), 3-6 de febrero de 1998, París, Francia.
33 Thompson C.B. (1995):“Apoptosis in the pathogenesis and treatment of diseases” Science Vol. 267, pág. 1456-
1462
34 Costa JL and Hofmann GA (1987): “Malignancy treatment” patente de los EE.UU. 4.665.898.
35 Narita K, Hanakawa K, Kasahara T, Hisamitsu T, Asano K (1997):“Induction of apoptotic cell death in
human leukemic cell line, HL-60, by extremely low frequency electric magnetic fields: analysis of the possible mechanisms
in vitro”. In vivo 111(4), págs. 329-335:
36 Raylman RR, Clavo AC, Wahl RL (1996) :“Exposure to Strong Static Magnetic Field Slow the Growth of
Human Cancer Cells In Vitro”. Bioelectromagnetics 17, págs. 358-363.
37 Haberkorn R, Michel-Beyerle ME. On the mechanism of magnetic field effects in bacterial photosynthesis.
Biophysical Journal 1979: 26:489-498.
38 Lersch W, Michel-Beyerle ME. Magnetic field effects on the recombination of radical ions in reaction centers
of photosynthetic bacteria. Chemical Physics 1983: 78:115-126.
39 Scaiano JC, Mohtat N, Cozens FL, McLean J and Thansandote (1994):“Application of the Radical Pair Mechanism
to Free Radicals I Organized Systems: Can the Effects of 60 Hz Be Predicted From Studies Under Static
Fields?” Bioelectromagnetics 15, págs. 549-554.
40 Engstrom S (1997):“What is the Time of Magnetic Field Interaction in Biological Systems?”. Bioelectromagnetics
18, págs. 244-249.
41 B.S. Thornton (1984): “Inversion of raman spectra of living cells indicates dielectric structure related to energy
control”, en Physics Letters, Vol. 106A, págs. 198-202.
42 S.T. Barsamian (1987): “Dielectric origin of living cells”, en Biophysical Aspects of Cancer, Charles University
Prague, págs. 152-159